美国LetPub SCI论文编辑
13 年
手机商铺
- NaN
- 0.2999999999999998
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
推荐产品
公司新闻/正文
恭喜!中科院1区Top!IF 19.9 的医学期刊《TRENDS PHARMACOL SCI》已成功发表!
856 人阅读发布时间:2026-01-04 15:19


-
环鸟苷酸-腺苷酸合成酶(cGAS)与干扰素基因刺激因子(STING)通路作为从细菌到人类高度保守的天然免疫机制,能介导强大的病毒抵抗能力。
-
cGAS介导的病毒识别系统在质膜、细胞质及细胞核等多重细胞区室中发挥作用。
-
多种病毒通过趋同进化、趋异进化和保守性进化等方式,演化出逃逸cGAS-STING介导的宿主防御通路的策略。
-
宿主抗病毒防御与病毒免疫逃逸机制之间的进化博弈,为开发治疗干预策略提供了新的契机。
环鸟苷酸-腺苷酸合成酶(cGAS)与干扰素基因刺激因子(STING)通路作为宿主先天免疫的关键组分,能在病毒感染过程中检测异常DNA。现有研究充分证明,病毒感染期间激活的cGAS-STING信号通路往往不足以实现病毒完全清除,这表明众多病毒已演化出针对这一重要通路的对抗机制。然而,病毒通过何种精确机制拮抗cGAS-STING通路以确保其在细胞内生存,目前仍未完全阐明。
本综述系统梳理了近期在阐明RNA与DNA病毒如何破坏cGAS-STING通路激活各阶段方面的研究进展。这些对病毒逃逸机制的深入解析,为开发靶向治疗策略提供了重要启示。特别值得注意的是,通过精准递送针对病毒逃逸蛋白设计的小分子或多肽类药物,将成为未来抗病毒治疗极具前景的发展方向。
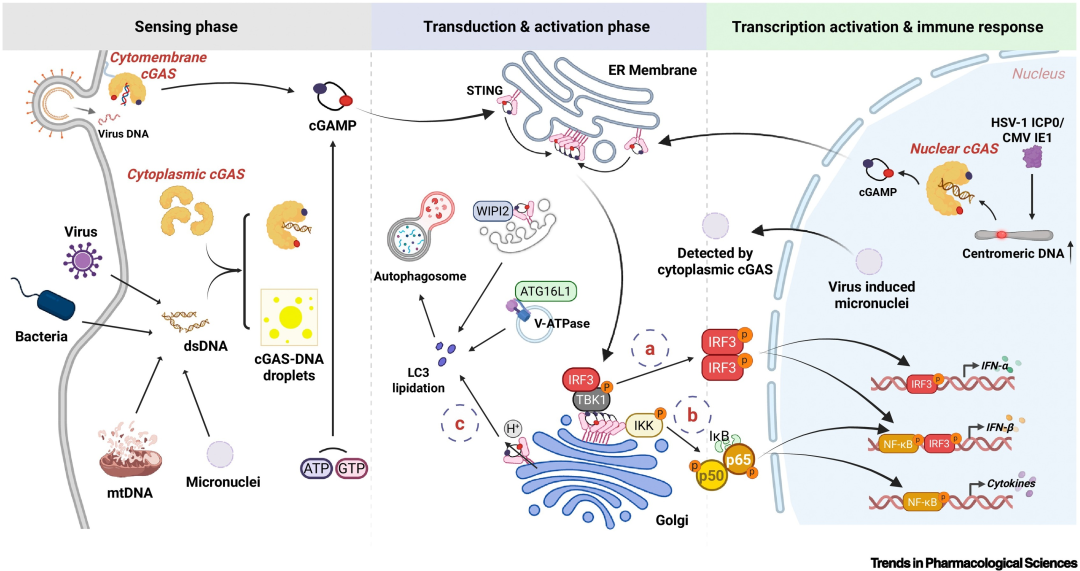
图1 cGAS-STING通路感知病毒感染与激活天然免疫的机制。
感知阶段: 当细菌或病毒等病原体感染时,定位于细胞膜、细胞质和细胞核的cGAS识别来自多种途径的异常细胞内DNA:(i) 病原体基因组DNA;(ii) 病原体诱导线粒体损伤后释放的线粒体DNA(mtDNA);(iii) 感染过程中核膜破裂产生的微核DNA;(iv) 病毒蛋白介导的核内着丝粒相关蛋白降解后异常扩增的着丝粒DNA。cGAS与DNA结合后,发生液-液相分离,催化ATP和GTP合成第二信使cGAMP。
转导与激活阶段: cGAMP与内质网驻留蛋白STING结合并激活之,触发STING寡聚化与构象改变。STING从内质网转运至高尔基体,并募集下游衔接蛋白,进而激活三条经典信号通路:(i) TBK1–IRF3通路;(ii) IKK–NF-κB通路;(iii) 自噬通路。
转录激活与免疫应答: STING–TBK1–IRF3信号通路激活触发IRF3二聚化与磷酸化,促使磷酸化IRF3入核,在I型干扰素反应中完全激活IFN-α并部分激活IFN-β。类似地,STING–IKK–NF-κB通路激活后,磷酸化的p50与p65亚基进入细胞核,完全促进促炎细胞因子的产生,并部分诱导IFN-β。
STING介导的自噬激活: STING作为质子通道促进质子泄漏,从而启动V-ATPase–ATG16L1依赖的LC3脂化过程。此外,STING通过其LC3互作区(LIR)募集WIPI2并直接与LC3互作,促进ATG5依赖的自噬诱导。
缩略词说明:ATG16L1,自噬相关16样蛋白1;cGAMP,环GMP-AMP;cGAS,cGAMP合成酶;CMV,巨细胞病毒;dsDNA,双链DNA;ER,内质网;HSV-1,1型单纯疱疹病毒;ICP0,感染细胞蛋白0;IE1,即刻早期蛋白1;IFN,干扰素;IKK,IκB激酶;IRF3,干扰素调节因子3;LC3,轻链3;LIR,LC3互作区;mtDNA,线粒体DNA;NF-κB,核因子κB;p,磷酸化;STING,干扰素基因刺激蛋白;TBK1,TANK结合激酶1;V-ATPase,液泡型ATP酶;H⁺,氢离子(质子);WIPI2,WD重复结构域磷酸肌醇互作蛋白2。本图使用BioRender绘制。
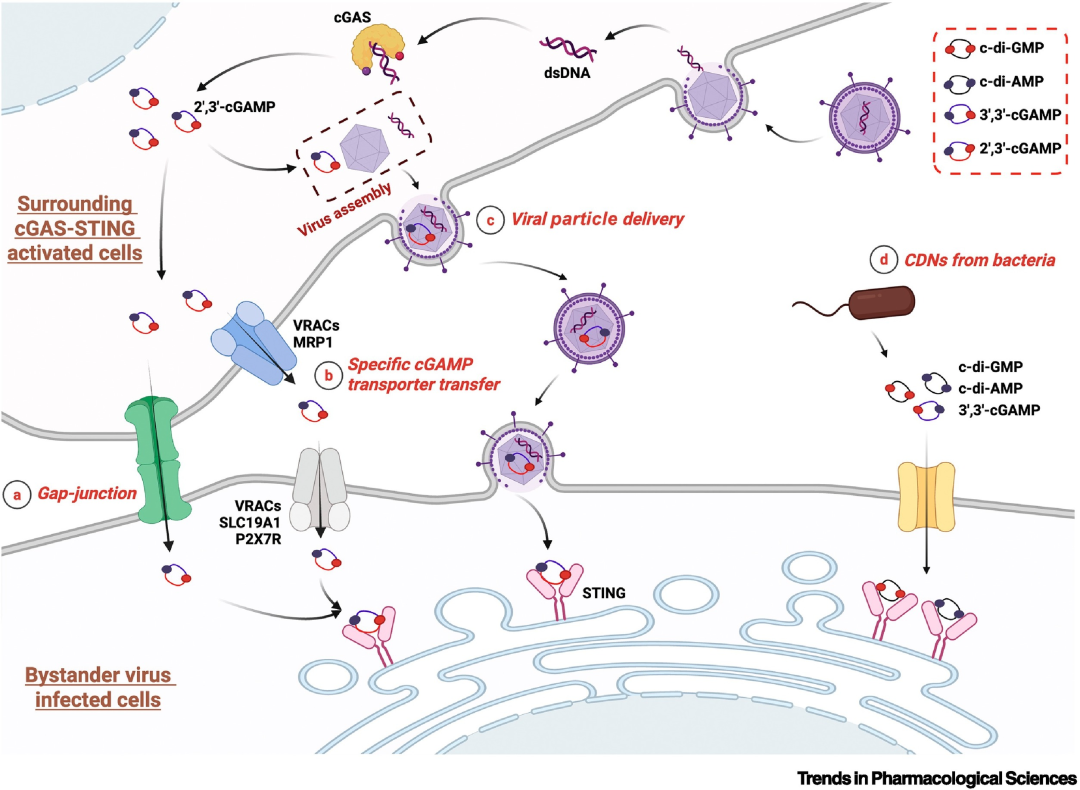
图2 周围环境中的STING激活机制。
在病毒感染过程中,病原体常采用拮抗机制来灭活受感染细胞内的cGAS-STING通路。然而,宿主已演化出精密的应对策略,通过间接机制重新激活这一关键防御系统,从而抑制病毒复制。这些补偿性策略包括:(a) 通过间隙连接从具有完整cGAS-STING信号通路的邻近细胞进行cGAMP的细胞间转移;(b) 通过特定转运蛋白(VRAC、MRP1、SLC19A1和P2X7R)从具有免疫活性的相邻细胞运输cGAMP;(c) 将cGAMP包装入病毒颗粒,递送至通路受损的细胞;(d) 在共感染期间摄取细菌来源的cGAMP。这种多层次的识别系统使宿主能够对入侵病原体维持持续的免疫压力,确保cGAS-STING通路不会被病毒的逃逸策略完全中和。
缩略词说明:cGAMP:环GMP-AMP;cGAS:cGAMP合成酶;CDNs:环二核苷酸;c-di-GMP:环二鸟苷酸;c-di-AMP:环二腺苷酸;dsDNA:双链DNA;MRP1:多药耐药相关蛋白1;P2X7R:嘌呤能受体P2X7;SLC19A1:溶质载体家族19成员1;STING:干扰素基因刺激蛋白;VRACs:容积调节性阴离子通道;本图使用BioRender绘制。
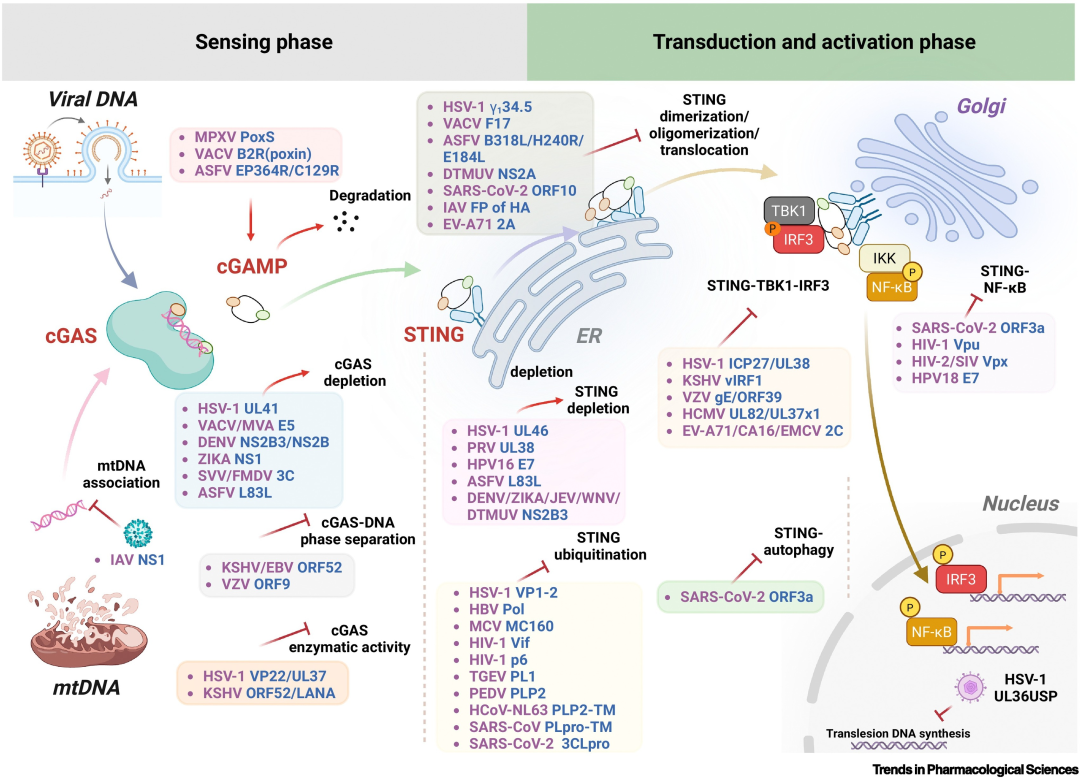
图3 病毒靶向cGAS-STING通路关键步骤的机制。
cGAS-STING通路施加的强大选择压力,促使多种病毒演化出对抗性策略以破坏这一先天免疫防御。病毒已发展出复杂策略,包括:隔离感染期间释放的线粒体DNA以防止cGAS识别、直接降解通路组分(cGAS、cGAMP或STING)以阻断信号传导,以及破坏STING的转运或其与下游效应分子(TBK1、IKKβ和LC3)的组装,从而选择性抑制特定信号分支。靶向cGAS-STING级联反应不同节点的病毒蛋白呈现显著多样性,既反映了该通路复杂的抗病毒机制及其病毒特异性限制模式,也凸显了宿主防御与病原体逃逸之间错综复杂的进化军备竞赛。
缩略词说明:3CLpro:3C样蛋白酶;ASFV:非洲猪瘟病毒;CA16:柯萨奇病毒A16;cGAMP:环GMP-AMP;cGAS:cGAMP合成酶;DENV:登革病毒;DTMUV:鸭坦布苏病毒;EBV:EB病毒;EMCV:脑心肌炎病毒;ER:内质网;EV-A71:肠道病毒A71;FMDV:口蹄疫病毒;FP:融合肽;HA:血凝素糖蛋白;HBV:乙型肝炎病毒;HCMV:人巨细胞病毒;HCoV-NL63:人冠状病毒NL63;HPV:人乳头瘤病毒;HSV-1:1型单纯疱疹病毒;IAV:甲型流感病毒;ICP:感染细胞蛋白;IKK:IκB激酶;IRF3:干扰素调节因子3;JEV:日本脑炎病毒;KSHV:卡波西肉瘤相关疱疹病毒;LANA:潜伏相关核抗原;MCV:传染性软疣病毒;MPXV:猴痘病毒;mtDNA:线粒体DNA;MVA:改良型痘苗病毒安卡拉株;NF-κB:核因子κB;NS1:非结构蛋白1;ORF:开放阅读框;p:磷酸化;PEDV:猪流行性腹泻病毒;PLP2:蛋白脂质蛋白2;PoxS:痘病毒-施拉芬蛋白;
PRV:伪狂犬病病毒;SIV:猴免疫缺陷病毒;STING:干扰素基因刺激蛋白;
SVV:塞内卡病毒;TBK1:TANK结合激酶1;TGEV:传染性胃肠炎病毒;VACV:痘苗病毒;Vif:病毒感染性因子;VP:病毒蛋白;VZV:水痘-带状疱疹病毒;WNV:西尼罗病毒;ZIKA:寨卡病毒;本图使用BioRender绘制。
cGAS-STING信号通路具有强大的抗病毒效应,这一点可从STING基因敲除小鼠对多种病毒的易感性显著增强以及STING激动剂在暴露前预防中展现的保护效力得到印证。然而,能够在宿主体内持续复制的病毒普遍演化出破坏该通路的机制,从而使宿主与病毒间的平衡向免疫逃逸方向倾斜。
为推进抗病毒治疗发展,针对病毒与cGAS-STING通路交互界面的干预至关重要。当前研究存在若干局限:缺乏病毒蛋白与cGAS/STING复合物的结构数据,研究主要集中于cGAS/STING激活的直接拮抗剂,且对抗病毒下游效应器的解析尚不完整——这些限制因素均阻碍了靶向药物的研发(详见待解问题)。
近期研究进展揭示了设计更优抗病毒策略的新机遇:一方面,可利用STING的内质网趋向性,构建内质网定位的STING激动剂-病毒抗原偶联物以实现双重免疫激活;另一方面,多组学/CRISPR筛选平台能够精细解析抗病毒机制与病毒拮抗作用的动态博弈。未来的抗病毒药物设计必须整合病毒蛋白与cGAS/STING-下游效应器相互作用的高分辨率结构信息,以阻断病毒蛋白对cGAS-STING通路的限制作用。这种基于结构的抗病毒设计方法,有望通过精准调控cGAS-STING的活化程度,在实现病毒清除的同时避免病理性的免疫过度激活。
当前STING激动剂的临床试验进展,结合正在发展的病毒拮抗剂抑制剂研究与结构解析突破,或将共同校准宿主-病毒平衡,使之趋向免疫保护方向。
本研究得到国家自然科学基金(项目编号:92169203、82341055、82102384、82172239、82271778、82303726、31970151)、浙江省自然科学基金(LY22C080002)以及中央高校基本科研业务费专项资金(226-2024-00062)的资助。我们感谢LetPub(www.letpub.com.cn)在本文撰写过程中提供的语言润色服务。

LetPub重磅推出4大核心投稿套餐,覆盖不同科研投稿场景


📢LetPub结合15年SCI论文编辑服务经验,推出四大投稿套餐,从语言润色、中译英翻译、行文逻辑结构优化、专家预审、材料准备到投稿系统指导,一站式支持您顺利投出高质量稿件!


